Das Wissen und das Verständnis molekularbiologischer Abläufe, die mit körperlicher Aktivität in Verbindung stehen, hat sich im Laufe der letzten drei Jahrzehnte stetig verbessert. Von der Skelettmuskulatur unter Belastung produzierte und freigesetzte Zyokine, Chemokine und Peptide entfalten auto-, para- und endokrine Wirkungen. Der vor wenigen Jahren zusätzlich eingeführte Begriff der "Exerkine" ergänzt das Bild um belastungsinduzierte Zytokinreaktionen weiterer Organsysteme. Nun rückt die Rolle von körperlicher Aktivität im Sinne einer "Poly-Pill" mehr denn je in den Fokus.
Der gesundheitliche Nutzen von Bewegung und die notwendige Reduktion von (vermeidbarer) Sitzzeit sind besonders im Kontext nicht-übertragbarer Erkrankungen heutzutage unbestritten (Bull et al. 2020). Regelmäßige körperliche Aktivität führt u.a. zu einer Verbesserung kardiometabolischer Prozesse und nimmt damit Einfluss auf den metabolischen Phänotyp verschiedener Gewebe und Organsysteme.
Aus gesundheitlicher Sicht werden aktuell 150 – 300 Minuten pro Woche an moderat intensiver, 75 – 150 Minuten intensiver körperlicher Aktivität oder eine Kombination daraus empfohlen. Neben Ausdauertraining wird auch zu einem moderaten Krafttraining, insbesondere der großen Muskelgruppen, an zwei oder mehr Tagen in der Woche geraten.
Die Botschaft ist letztlich "Je mehr desto besser", d. h. auch über die 300 Minuten moderate bzw. 150 Minuten intensive körperliche Bewegung hinaus (Bull et al. 2020).
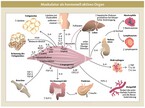
Diese positiven Effekte werden u.a. durch Myokine gesteuert. Dabei handelt es sich um Zyokine, Chemokine und Peptide, die von der Skelettmuskulatur produziert bzw. freigesetzt werden und eine auto-, para- und endokrine Wirkung entfalten. Abgeleitet wurde dieser Name aus dem griechischen "mys" für Muskel bzw. "kinesis" für Bewegung (Pedersen et al. 2008). Der zusätzlich vor wenigen Jahren eingeführte Begriff der "Exerkine" ergänzt das Bild um die belastungsinduzierte Zytokinreaktion weiterer Organsysteme (Chow et al. 2022), da es zu weiteren kurz- bzw. langfristigen trainingsinduzierten Reaktionen auch in anderen Geweben kommt. Auch wenn die genauen Prozesse bislang noch nicht final aufgedeckt wurden, hat sich in den letzten zwei bis drei Jahrzehnten das Wissen und das Verständnis dieser belastungsinduzierten molekularbiologischen Abläufe deutlich verbessert und die Rolle von körperlicher Aktivität als "Poly-Pill" mehr denn je in den Fokus gerückt.
Ausgewählte Wirkmechanismen
Die Skelettmuskulatur stellt mit etwa 40 bis 50 % bei Normalgewicht eines unserer größten Organe dar.
Neben der "klassischen" Rolle als Verbrennungsmotor gilt die Skelettmuskulatur inzwischen auch als immunregulierendes Organ.
So beschrieben Ostrowski et al. (1998) bereits vor mehr als zwei Jahrzehnten einen Anstieg von Interleukin (IL)-6 um das etwa 100fache nach einem Marathonlauf, der nicht – wie bei "normalen" Entzündungen – von einer IL-1- bzw. TNF-α-Steigerung begleitet wurde. Vielmehr kommt es bewegungsbedingt vermittelt durch IL-6 zur Produktion des IL-1-Rezeptor-Antagonisten (IL-1ra) sowie von IL-10 durch mononukleäre Zellen im Blut (Steensberg et al. 2003). Der IL-1ra wiederum hemmt die Signaltransduktion des proinflammatorischen IL-1ß. IL-10 hemmt u. a. die Synthese von TNF-α und wirkt somit antiinflammatorisch (zusammengefasst in Pedersen 2017).
Die Zahl der beschriebenen Myokine schwankt zwischen 600 bis zu 3.000. Zu den bekanntesten Vertretern zählen neben dem IL-6 das IL-7, der "brain derived neurotrophic factor" (BDNF), Myostatin und der leukämiehemmende Faktor (LIF), die im Wesentlichen den Muskelumbau und die Hypertrophie induzieren.
IL-15, Irisin, METRLN und β-Aminoisobuttersäure (BAIBA) sind neben IL-6 an der Stimulierung der Oxidation freier Fettsäuren und der Lipolyse beteiligt und induzieren damit die Umwandlung von weißen in braune Fettzellen ("Browning" oder "Beiging"). So kommt es weniger zu einer Energiespeicherung, sondern zur Wärmeabgabe i. S. der Thermogenese. Beschrieben wird außerdem eine verbesserte Endothelfunktion, eine vermehrte Angiogenese (z. B. durch IL-8), die Revaskularisierung von ischämischen Gefäßen (z. B. durch Follistatin-Related Protein 1) sowie eine Steigerung der Knochenbildung (z.B. durch IGF-1, FGF-2 und TGF-b).
Irisin, Fraktalkine, BDNF, Apelin etc. werden auch im Kontext neurodegenerativer Erkrankungen diskutiert (zusammengefasst in Lee et al. 2021). Darüber hinaus scheinen einige Myokine, z. B. IL-6, Myostatin, IL-15, Irisin, Fibroblasten-Wachstumsfaktor 21 (FGF21) und Musclin die Angiogenese und die Mikroumgebung des Immunsystems bei Tumorerkrankungen, aber auch die Tumorkachexie zu regulieren (Huang et al. 2022).
Ausgewählte Aspekte der Exerkine
Neben Muskelfasern tragen auch Satellitenzellen, Fibroblasten, Immunzellen, Endothelzellen sowie die extrazelluläre Matrix zur Freisetzung der Zytokine bei (Hoffmann und Weigert 2017). Es gibt darüber hinaus noch weitere Biomoleküle, die als Peptide und Metaboliten infolge einer akuten Belastung oder Training von praktisch jedem Organ in den Blutkreislauf entweder direkt oder durch extrazelluläre Vehikel (EVs) wie Exosomen abgegeben und zu den jeweiligen Zielmolekülen und Rezeptoren transportiert werden.
Auch mikroRNA (miRNA) als nicht kodierende RNAs verschiedener Zelltypen kontrollieren die Expression eines Genpools und führen zu einer posttranskriptionellen Regulierung (Da Silva et al. 2017). Sie werden ebenfalls durch körperliche Aktivität exprimiert und modulieren u. a. trainingsbedingte kardiovaskuläre Anpassungen (Silva et al. 2017) wie die Muskelhypertrophie und -regeneration (Sharma et al. 2014). Weitere molekulare Ziele und Rezeptoren für diese Exerkine finden sich u. a. auch wieder in der Skelettmuskulatur, im Fettgewebe, in Leber, Bauchspeicheldrüse, Knochen, Herz, Immun- und Gehirnzellen.
Dabei spielen sich die Effekte von Ausdauertraining eher im Kontext kardiometabolische Anpassungsreaktionen ab, während die eines Krafttrainings eher auf struktureller, muskulärer Ebene zu finden sind (Leuchtmann et al. 2021).
Andere Sportarten, z. B. aus dem Bereich Body-and-Mind, sind hinsichtlich ihrer Zusammenhänge mit Myokinen oder Exerkinen nicht bzw. kaum untersucht.
Conflict of Interest:
Es bestehen keine Interessenkonflikte von Christine Joisten bei der Erstellung dieses Berichts.
Erschienen in: Diabetes-Congress-Report, 2023; 23 (1) Seite 10-13